核心提示: 近日,我校生命科学技术学院、农业微生物学国家重点实验室端木德强教授课题组在国际学术期刊PNAS在线发表了关于叶绿体信号分子胆色素调控叶绿素合成的最新研究进展,阐明了光合微生物中胆色素小分子通过镁螯合酶激活蛋白GUN4在转录后水平调控叶绿素合成的分子机制。
南湖新闻网讯(通讯员 张维清)近日,我校生命科学技术学院、农业微生物学国家重点实验室微生物光合作用与生物固氮团队端木德强教授课题组揭示了模式生物莱茵衣藻中胆色素分子通过GUN4蛋白调控叶绿素合成的分子机制,拓宽了对叶绿素合成调控的理解,并对探究叶绿体重要信号分子胆色素的更多生物学功能提供了新的见解。相关科研成果发表在在国际学术期刊PNAS上。
光合作用是地球上最重要的化学反应,利用太阳能将环境中的CO2转化为有机物,将光能转化为化学能,是绝大多数生命活动的能量和物质来源。光合微生物被誉为阳光驱动的细胞工厂,供应了超过50%的地球大气层氧气和全球初级生产力,是生物圈物质能量循环的主要原动力。对微生物高光效机理及其精准调控机制的研究是光合作用研究领域的重要创新方向。光合生物通过四吡咯途径合成叶绿素。在叶绿体中,四吡咯前体物质5-氨基乙酰丙酸(ALA)至原卟啉IX(PPIX)处发生分支,形成叶绿素分支和血红素分支。胆色素(BV或PCB)是血红素分支的代谢产物,通常作为光受体光敏素或捕光蛋白藻胆体的生色团,参与光的感知与捕获。在缺乏光敏素和藻胆蛋白的莱茵衣藻中,胆色素作为叶绿体反向信号,缓解光-暗转变过程中产生的氧化胁迫并维持光合自养生长和光合系统I的稳定性。前期研究表明,胆色素的缺乏会影响衣藻细胞叶绿素的积累,但相应分子机制并不清楚。
叶绿素的生物合成受到多方面的调控,其中,ALA合成和镁离子螯合酶(MgCh)是调控叶绿素合成的两个重要节点。MgCh是由CHLH、CHLI和CHLD组成的多亚基复合物,负责叶绿素合成分支第一步反应。GUN4是一种在放氧型光合生物中普遍存在的蛋白,能与MgCh催化亚基CHLH互作并结合其底物和产物,作为MgCh的辅因子激活其活性并参与叶绿素合成调控。
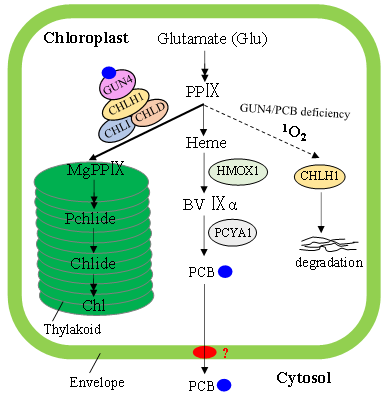
图1 叶绿体信号分子胆色素(PCB)和GUN4调控叶绿素合成的模式图
本研究首先通过光谱分析和蛋白-小分子互作检测等多种生化手段发现衣藻GUN4能与胆色素非共价结合,形成不具有光活化特性及荧光特性的复合物。PPIX具有光敏特性,与GUN4结合之后荧光强度急剧上升,而胆色素PCB则能有效猝灭该荧光(60倍以上)并形成GUN4:PCB:PPIX复合物。体外MgCh活性检测实验表明,在GUN4存在的情况下,胆色素能够显著增加MgCh活性20倍以上。免疫印迹实验显示,GUN4或胆色素的缺乏均会导致衣藻细胞内MgCh催化亚基CHLH1的积累大幅度减少。突变体表型分析表明,GUN4和胆色素的同时缺乏会严重影响衣藻细胞光养生长缺陷表型,使细胞呈现黄棕色。化学互补实验则进一步证实,GUN4和胆色素对于CHLH1蛋白和叶绿素的积累都发挥重要作用。
研究首次揭示了血红素分支产物胆色素与叶绿素分支第一步反应的调控蛋白GUN4互作、促进镁螯合酶MgCh活性及维持MgCh催化亚基CHLH1的稳定性,提出了一种小分子-蛋白(Bilin-GUN4)互作在转录后水平调节叶绿素合成的新型调控机制,并进而提出该调控途径在内共生起源的蓝细菌、真核藻类及高等植物等光合生物中可能普遍存在。该研究不仅丰富了我们对叶绿素合成调控的理解,也为胆色素的多样化且进化上保守的生物学功能研究提供了重要依据。
华中农业大学生命科学技术学院、农业微生物学国家重点实验室端木德强教授和美国加州大学戴维斯分校J. Clark Lagarias教授为该论文的共同通讯作者,端木德强教授课题组张维清博士为该论文唯一第一作者。本工作ITC实验得到学校蛋白质平台殷平、张德林老师的协助。该工作得到国家自然科学基金、华中农业大学自主科技创新基金及生命科学技术学院龙云计划创新团队的资助。
【英文摘要】
Biosynthesis of chlorophyll and heme in oxygenic phototrophs share a common trunk pathway that diverges with insertion of magnesium or iron into the last common intermediate, protoporphyrin IX. Since both tetrapyrroles are pro-oxidants, it is essential that their metabolism is tightly regulated. Here we establish that heme-derived linear tetrapyrroles (bilins) function to stimulate the enzymatic activity of magnesium chelatase (MgCh) via their interaction with GUN4 in the model green alga Chlamydomonas reinhardtii. A key tetrapyrrole-binding component of MgCh found in all oxygenic photosynthetic species, CrGUN4 also stabilizes the bilin-dependent accumulation of protoporphyrin IX-binding CrCHLH1 subunit of MgCh in light-grown C. reinhardtii cells by preventing its photooxidative inactivation. Exogenous application of biliverdin IXα reverses the loss of CrCHLH1 in the bilin-deficient heme oxygenase (hmox1) mutant, but not in the gun4 mutant. We propose that these dual regulatory roles of GUN4:bilin complexes are responsible for retention of bilin biosynthesis in all photosynthetic eukaryotes to sustain chlorophyll biosynthesis in an illuminated oxic environment.
论文链接: https://www.pnas.org/content/118/20/e2104443118
审核人:端木德强
